Bespreking van de aardalkalimetalen
Aardalkalimetalen worden massaal gebruikt als legeringselement in constructiemetalen. Een koperlegering met 6-8% Beryllium geeft koper de sterkte en hardheid van constructiestaal, met behoud van de goede elektrische geleidbaarheid. Magnesium is een zeer licht metaal dat onmisbaar is als metaal en als legeringselement; denk aan vliegtuigen, ruimtevaart, carrosserieën, bouw- en jachtbeslag. Calcium reduceert de oxiden van Titaan, Zirkonium, Chroom en Uranium tot de zuivere elementen. Verbindingen van Magnesium, Calcium, Strontium en Barium geven vuurwerk kleur.Plaats van de aardalkalimetalen in het periodiek systeem
Aardalkalimetalen is de groep elementen in kolom 2 in het periodiek systeem, namelijk Berilium(Be), Magnesium(Mg), Cadmium(Cd), Strontium(Sr), Barium(Ba) en Radium(Ra). Ze hebben als overeenkomst dat ze allemaal twee (valentie)elektronen in de buitenste s-subschil hebben die het atoom gemakkelijk loslaat, waardoor tweewaardige positieve metaalionen ontstaan volgens de vergelijking: M→M2+ + 2e- ; (M staat voor een aardalkalimetaal)Reactiviteit van de aardalkalimetalen
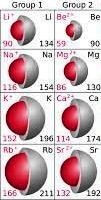 Afb. 2. Kolom 1 zijn de alkalimetalen, kolom 2 zijn de aardalkalimetalen / Bron: Popnose, Wikimedia Commons (CC BY-SA-3.0)
Afb. 2. Kolom 1 zijn de alkalimetalen, kolom 2 zijn de aardalkalimetalen / Bron: Popnose, Wikimedia Commons (CC BY-SA-3.0)De grotere atomen van de aardalkalimetalen reageren agressiever als de kleinere atomen omdat bij de grote atomen de bindingskracht tussen atoomkern en de buitenste twee (valentie)elektronen minder is vanwege de grotere afstand tussen kern en de valentie-elektronen. Kleinere atomen houden hun buitenste elektronen steviger vast en zijn minder geneigd zich te verbinden met een ander atoom)
Belangrijke reactie van elementaire aardalkalimetalen
Reactie met zuurstof: M(s) + O2(g) → MO(s)Reactie met een halogeen: M(s) + X2 → MX2(s); (X staat voor een halogeen)
Reactie met water: M(s)2 + H2O(L) → M (OH)2(aq) H2↑(g)
En zure reactie: 2H(aq) + M(s) → M2(aq) H2↑(g)
Verschil tussen aardalkalimetalen en alkalimetalen
Groep(kolom) 1 volgens afbeelding 2 zijn de alkalimetalen en groep(kolom) 2 zijn de aardalkalimetalen.
Beryllium: Het element
Bij gewone temperaturen is beryllium bestand tegen erosie en oxidatie door weer en wind. De mogelijkheid om een kras in glas te maken komt door de vorming van een harde oxide laag. Beryllium is ontdek…
Strontium: Het element
A. Crawford ontdekte in 1790 dat strontium een element is. Het metaal werd geïsoleerd door Sir Humphry Davy in London in 1808. De naam verwijst naar de Schotse plaats Strontian waar zich strontiumhoud…
Radium: Het element
Naam is afgeleid van Lat. radius dat straling betekent. Radium wordt gewonnen als bijproduct van uranium winning en geleverd als radiumchloride (RaCl2) en radiumbromide (RaBr2). Een ton uranium bevat…
Magnesium: Het element
Magnesium Mg is een zilverwit aardalkalimetaal met een zeer laag soortelijk gewicht. Legeringen van magnesium worden gebruikt in de luchtvaart- en auto-industrie. In 1808 ontdekt Humphry Davy dat magn…
Barium: Het element
Barium is in 1774 geïdentificeerd door Carl Wilhelm Scheele en in 1808 geïsoleerd door Humphry Davy door elektrolyse van gesmolten bariumoxide. De naam barium is afgeleid van het Griekse Barys dat zwa…
Calcium: Het element
Calcium is een zacht zilverwit aardalkalimetaal dat in 1808 als element werd ontdekt en door middel van elektrolyse geproduceerd door Humphry Davy. De naam is afkomstig van het Latijnse Calx, "kalkste…Gepubliceerd door Custor op 24-03-2015, laatst gewijzigd op 09-05-2015. Het auteursrecht (tenzij anders vermeld) van deze special ligt bij de infoteur. Zonder toestemming van de infoteur is vermenigvuldiging verboden.
Bronnen en referenties
- http://www.wetenschapsforum.nl/index.php/topic/5160-reactiviteit-aardalkalimetalen/
- Informatica.pvanhorne.nl/~stijn.c/getPage.php?lang=nl&page=Aardalkalimetaal&i=0
- http://nl.swewe.com/word_show.htm/?37587_1&Een%7Caardalkalimetaal