Bespreking van de niet-metalen
 Een niet-metaal element staan atomen, in tegenstelling tot de metalen, niet gemakkelijk een elektron af. Niet-metalen hebben een hogere elektronegativiteit en zijn daardoor sterke oxidatoren. De meeste niet-metalen zijn slechte geleiders van elektriciteit. De niet-metalen kunnen bij kamertemperatuur gasvormig, vloeibaar of vast zijn. Bij lagere temperatuur vormen zij in het algemeen vaste stoffen met een molecuulrooster. Niet-metalen vormen een ionen verbinding met metalen. Onderling vormen niet-metalen vaak covalente bindingen.Ook in de organische chemie zijn niet-metalen belangrijk.
Een niet-metaal element staan atomen, in tegenstelling tot de metalen, niet gemakkelijk een elektron af. Niet-metalen hebben een hogere elektronegativiteit en zijn daardoor sterke oxidatoren. De meeste niet-metalen zijn slechte geleiders van elektriciteit. De niet-metalen kunnen bij kamertemperatuur gasvormig, vloeibaar of vast zijn. Bij lagere temperatuur vormen zij in het algemeen vaste stoffen met een molecuulrooster. Niet-metalen vormen een ionen verbinding met metalen. Onderling vormen niet-metalen vaak covalente bindingen.Ook in de organische chemie zijn niet-metalen belangrijk.
Plaats in periodiek systeem
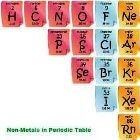
De niet metalen staan rechts boven in het periodiek systeem: Koolstof - Stikstof - Zuurstof - Fosfor - Zwavel - Seleen (halogenen en waterstof worden ook vaak tot de niet-metalen gerekend).Niet metalen in het periodiek systeem:
- Meer-atomig niet-metaal
- Twee-atomig niet-metaal
- Edelgas
Definitie en eigenschappen
Er is geen ondubbelzinnige definitie van niet-metalen. Ze tonen meer variatie in hun eigenschappen dan metalen. Belangrijkste kenmerken van niet-metalen zijn: grotendeels bestaan als een-atomige gassen, met enkele twee-atomige of meer-atomige moleculen, in tegenstelling tot metalen die uit geordende atoomroosters bestaan. zij algemeen dof en bros, in tegenstelling tot metalen, die glanzende, buigzaam of vervormbaar zijn; ze hebben meestal lagere dichtheden dan metalen; zijn slechte geleiders van warmte en elektriciteit en hebben aanzienlijk lagere smelt en kookpunt dan die van metalen (met uitzondering van koolstof).Relevante elementen
De elementen geclassificeerd als niet-metalen omvatten één element per groep 1 en groep 14: waterstof (H) en koolstof (C); twee elementen van groep 15: stikstof (N) en fosfor (P); drie elementen uit groep 16 : zuurstof (O), zwavel (S) and selenium (Se). meeste elementen van groep 17 (halogenen): fluor (F), chloor (Cl), broom (Br) en jood (I); en alle elementen in groep 18 (edelgassen).Zeventien elementen worden geclassificeerd als niet-metalen; meeste zijn gassen (waterstof, helium, stikstof, zuurstof, fluor, neon, chloor, argon, krypton, xenon en radon); één een vloeistof (broom); en enkele vaste stoffen (koolstof, fosfor, zwavel, selenium.
Vergelijking van de eigenschappen van metalen, niet-metalen, en metalloiden
- In het periodiek systeem, zijn er drie belangrijke types elementen namelijk metalen, niet-metalen, en Metalloïden. kenmerkende eigenschappen van metalen, niet-metalen, en metalloiden:
- Metalen zijn meestal glanzend, kneedbaar, sterk en hard. Metalen zijn goede geleiders van elektriciteit en warmte. Voorbeelden van metalen zijn goud, zilver, ijzer, uranium, aluminium en zink.
- Niet-metalen geleiden warmte en elektriciteit niet goed. Niet-metalen zijn bros en niet gemakkelijk in vormen te gieten. Niet-metalen elementen zijn bijvoorbeeld waterstof en koolstof.
- Metalloïden hebben kenmerken van zowel metalen als niet-metalen en worden wel halfmetalen genoemd. Metalloïden zijn meestal semi-conductors, wat betekent dat ze zowel kunnen isoleren als elektriciteit geleiden. Deze eigenschap maakt Metalloïden zeer geschikt als computerchip materiaal. Voorbeelden van metalloiden zijn van silicium en Boron.

Fosfor: Het element
Fosfor is een scheikundig element met symbool P. Het is een niet-metaal dat in verschillende kleuren kan voorkomen waarvan rode- en witte fosfor het bekendst zijn. Fosfor is in 1669 ontdekt door alche…
Selenium: Het element
Selenium is een element die in de natuur in gesteenten en de bodem voorkomt. In zuivere vorm bestaat het als metallisch grijs tot zwarte hexagonale kristallen. Meestal in aanwezigheid van sulfide of z…
Zwavel: Het element
Zwavel wordt gebruikt voor de bereiding van zwavelzuur, voor het vulkaniseren van rubber, voor plantenziekte bestrijding, voor de luciferfabricage, voor de bereiding van zwavelkoolstof en voor zwavelv…
Koolstof: Het element
Koolstof (Latijn: carbo "steenkool") is een scheikundig element met symbool C en atoomnummer 6. Het is lid van groep 14 van het periodiek systeem. Het is een niet-metaal en heeft vier (valencie)elektr…
Stikstof: Het element
Stikstof is een chemisch element met symbool N en atoomnummer 7. Het is een transparant tweeatomig gas en het lichtste element van de stikstofgroep. Stikstof is een veel voorkomende element in het hee…
Zuurstof: Het element
Zuurstof is een scheikundig element met symbool O (van oxygen) en atoomnummer 8. Het is een lid van de chalcogeen groep in het periodiek systeem en een zeer reactive nietmetaal en oxidatiemiddel. Het…Gepubliceerd door Custor op 10-04-2015. Het auteursrecht (tenzij anders vermeld) van deze special ligt bij de infoteur. Zonder toestemming van de infoteur is vermenigvuldiging verboden.
Bronnen en referenties
- http://chemistry.tutorvista.com/inorganic-chemistry/metals-non-metals-metalloids.html (Niet-metaal embleem)
- http://nl.wikipedia.org/wiki/Niet-metaal
- http://www.visionair.nl/wetenschap/het-periodiek-systeem-waterstof-h-nr-1-van-118/ (Afbeelding: periodiek systeem van elementen)l
- http://en.wikipedia.org/wiki/Nonmetal